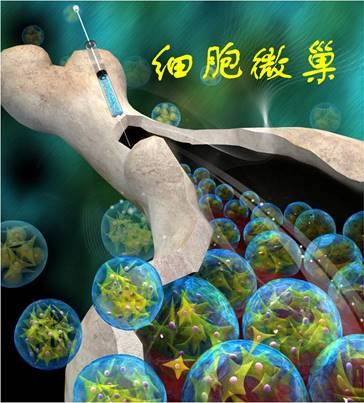
图1. 细胞微巢示意图
近期,生命学院赵昕副教授和哈佛大学David Weitz院士共同合作,基于微流控光交联技术联合开发了一种 “细胞微巢”,构建出一种可注射光交联天然高分子基的水凝胶微球,实现了同时装载骨髓间充质干细胞(BMSCs)和生长因子的目标,不仅保持了BMSCs生长的优良微环境,还可以局部微创注射到骨缺损位置实现骨的快速再生。相关文章发表在Adv. Funct. Mater. 2016, DOI: 10.1002/adfm.201504943。
干细胞移植,是一门先进的医学技术,为一些疑难杂症的治疗带来了希望。干细胞移植是把健康的干细胞移植到患者体内,以修复或替换受损细胞或组织,从而达到组织再生的目的。骨髓间充质干细胞(BMSCs)具向多种细胞分化的潜能,在骨再生过程中倍受青睐。在骨科疾病治疗中,为尽量减小外伤,常借助微创手术将BMSCs注射到损伤位置进行干细胞移植,用该方法治疗疾病具有创伤小、恢复快等优点,因此在临床上具有很好的应用前景。但是,直接注射干细胞时,其细胞膜在组织内剪切力下存在被破坏的危险,以及有局部保留性差、贴附性差和缺少三维微环境支持等问题,使得注射的干细胞存活率低、组织再生效能低。因此,在不影响微创治疗的同时,给注射的干细胞提供适宜的微环境载体可以保持干细胞活性和分化潜能,从而拓展干细胞在组织修复中的应用。
该研究成果首先基于前期合成的可光交联的天然高分子明胶水凝胶的工作基础,他们将微流控技术和干细胞治疗技术相结合,构建出一种柔软的可注射水凝胶微球,成功实现了对活体干细胞和生长因子的装载。其次,通过调节微环境中的生物力学、降解、生长因子释放速率等因素,动态实现了“细胞微巢”内细胞的立体增殖和分化,从而促进BMSCs的成骨分化等。最后,体内研究证实了该“细胞微巢”可以快速实现局部新骨的再生和重建。该工作为干细胞在临床上微创治疗提供了一种新的技术和思路。
