慢性痛是一类严重危害人类健康的重大神经系统疾病,全世界20-30%的人群一生中会经历慢性痛的折磨,其病程可长达数年乃至终身。除疼痛感之外,慢性痛往往还会引发焦虑、抑郁、厌恶情绪、认知改变等一系列并发症状,同时,负性情绪也会进一步加重慢性疼痛,慢性痛病程的长期持续和不断加剧往往使患者痛不欲生。然而,与急性痛相比,临床上依然缺乏有效且副作用小的慢性痛治疗药物。目前,对疼痛感知的中枢调控机制已有系统研究,并形成从分子、突触到环路等不同层面的神经可塑性变化的系列假说。然而这种可塑性变化的长期维持需要类似于“学习记忆再巩固过程”长期的伤害性刺激输入。因此,神经可塑性的改变往往是逐渐衰减的过程,并不能完全解释慢性痛的渐进性进展机制。因此,慢性痛的发生与进展机制,慢性痛是如何在受伤组织愈合后得以长期维持和持续加重,不但是本领域最受关注的关键科学问题,也是临床上重要的世界医学难题。
西安交通大学生命学院王昌河教授团队综合运用神经环路示踪技术、电生理与电化学记录、清醒动物双光子Ca2+成像、光纤记录等,首次发现痛觉信息处理中枢(前扣带回皮层,ACC)与情感中枢(腹侧被盖区,VTA)之间形成的正反馈神经闭环。该闭环由ACC谷氨酸能神经元(ACCGlu)、VTA中间GABA能神经元(VTAGABA)和VTA多巴胺能神经元(VTADA)依次连接所构成:ACCGlu神经元通过VTAGABA神经元间接抑制VTADA神经元,进而介导慢性痛伴发的负性情绪改变;同时,VTADA神经元反向投射至ACCGlu神经元介导负性情绪对痛觉异常的反馈调节。因此,ACCGlu-VTAGABA-VTADA-ACCGlu作为痛觉中枢与情感中枢之间的正反馈神经闭环,不仅是痛觉感知与情绪状态交互调控的重要桥梁,也是痛觉和共病情绪障碍之间相互促进的核心机制,还是慢性疼痛长期维持和持续进展的重要中枢机制(图1)。该研究不仅揭示了新型“正反馈闭环回路”及其在慢性痛的长期持续及与情绪障碍共病的核心机制,也为慢性痛的治疗提供了新靶点和干预新策略,并为其他脑生理与脑疾病研究提供新的范式和新思路。
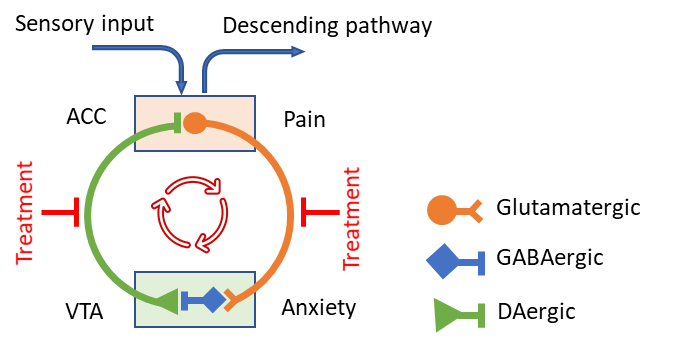
图1 ACC-VTA – ACC正向反馈环路介导慢性痛的长期维持
(图源:Qian Song,et al.,Nature Neuroscience, 2024)
ACCGlu-VTAGABA-VTADA环路介导慢性痛及相关负性情绪改变
坐骨神经分支损伤(SNI)是一种经典的慢性痛模型,SNI小鼠除痛觉异常外,还会表现出多种负性情绪(焦虑、抑郁、厌恶)反应。团队通过电生理和电化学记录发现,SNI鼠VTADA神经元兴奋性降低、多巴胺分泌减少,化学激活VTADA神经元则能有效缓解慢性痛及其负性情绪改变。病毒示踪结果表明,痛觉信息处理中心ACCGlu神经元可直接投射到VTA区,结合化学遗传学偶联的电生理记录,团队发现ACCGlu神经元通过兴奋VTAGABA神经元间接抑制VTADA神经元,进而介导慢性痛伴发的负性情绪改变(图2A-E)。相反,通过化学抑制ACCGlu神经元向VTA的投射则能有效缓解慢性痛的痛敏异常及其诱发的负性情绪(图2F-M)。这些结果表明,ACCGlu神经元对VTADA神经元的抑制性调控是介导慢性痛相关负性情绪改变的重要机制。
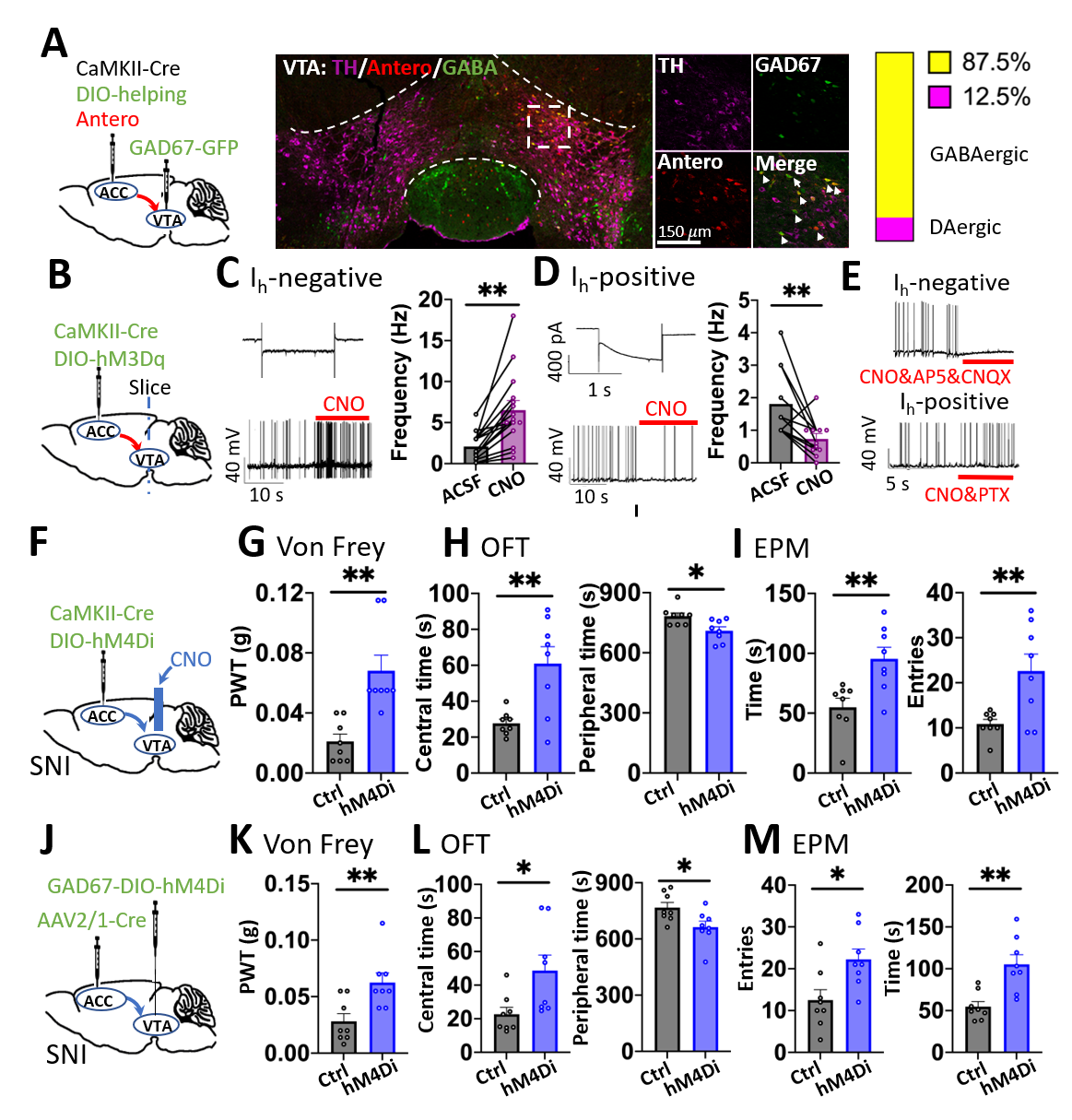
图2 ACCGlu-VTAGABA-VTADA环路调控慢性痛及其负性情绪
(图源:Qian Song,et al.,Nature Neuroscience, 2024)
ACCGlu-VTAGABA-VTADA-ACCGlu正反馈闭环调控慢性痛及其负性情绪
研究团队进一步发现,VTADA神经元还可直接反向投射至ACCGlu神经元,介导负性情绪对慢性痛的反馈调节。团队推测,这群接收VTADA投射的ACCGlu神经元可能就是投射到VTA区域最初的ACCGlu神经元,从而在结构上形成一个封闭的神经环路。为了论证这一大胆的猜想,团队通过多重示踪病毒标记-光遗传偶联的电生理记录实验,证明在ACC和VTA脑区之间的确形成了ACCGlu-VTAGABA-VTADA-ACCGlu闭环的结构与功能连接(图3A-D)。进一步,团队利用清醒动物双光子在体钙成像(图3E)与自由行为动物在体光纤记录(图3F-H)在活体动物层面证明,化学抑制VTADA神经元向ACC的投射末梢的确可兴奋投射到VTA的ACCGlu神经元,且这种兴奋效应在SNI鼠中显著降低。更进一步,在行为调控层面,光遗传激活接受ACCGlu调控的VTADA神经元向ACC的投射末梢,可有效缓解SNI模型小鼠的痛敏异常及其诱发的负性情绪(图3I-L)。这些结果表明,痛觉信息处理中枢ACC与情感中枢VTA之间的确存在完整的ACCGlu-VTAGABA-VTADA-ACCGlu正反馈神经闭环,而这一闭环则是介导慢性痛与负性情绪之间相互促进的关键机制。
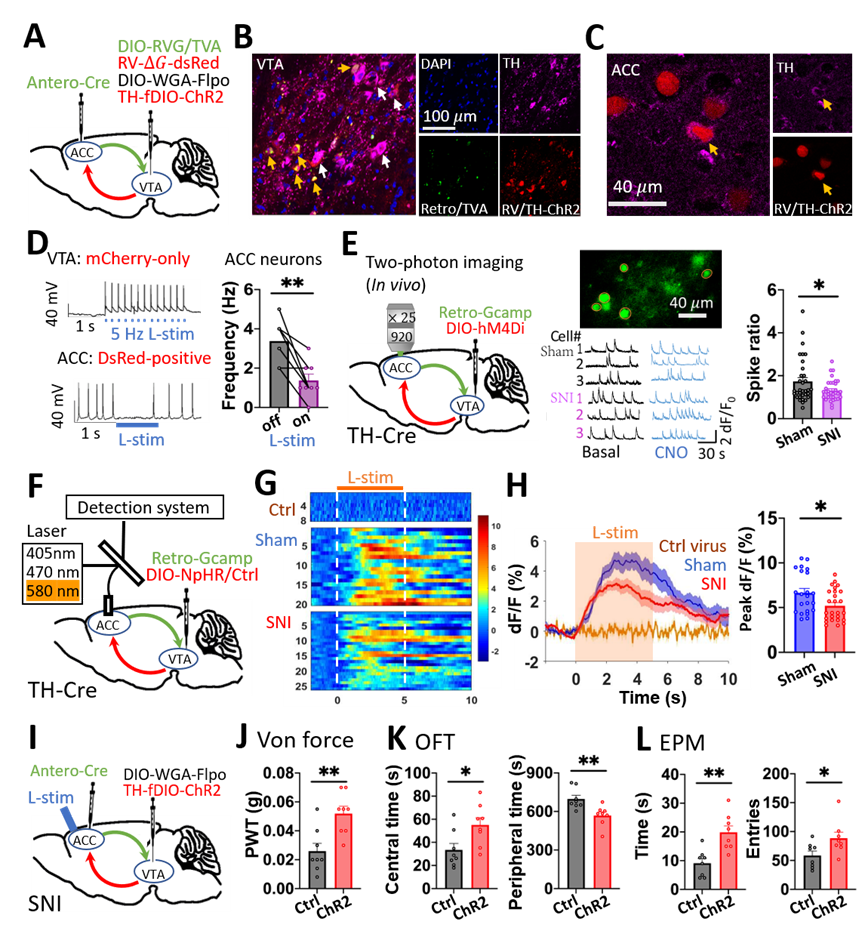
图3 ACCGlu-VTAGABA-VTADA- ACCGlu闭环调控慢性痛及其负性情绪
(图源:Qian Song,et al.,Nature Neuroscience, 2024)
ACC-VTA-ACC正反馈闭环介导慢性痛及其负性情绪的长期维持
为进一步验证ACC-VTA-ACC正反馈闭环在慢性痛渐进性进展与长期维持中的调控作用,团队利用化学遗传学方法持续激活ACCGlu神经元向VTA的投射或抑制VTADA神经元向ACC的投射,发现两种方式均可激活ACC-VTA-ACC正反馈闭环,不仅导致ACCGlu神经元和VTADA神经元兴奋性水平的长期改变,还可导致小鼠发生痛觉增敏和焦虑样症状,且这种病理性改变可长期持续(图4)。因此,ACC-VTA-ACC正反馈闭环不仅是痛觉与情绪互作的核心机制,还是慢性痛渐进性进展与长期维持的重要中枢机制。
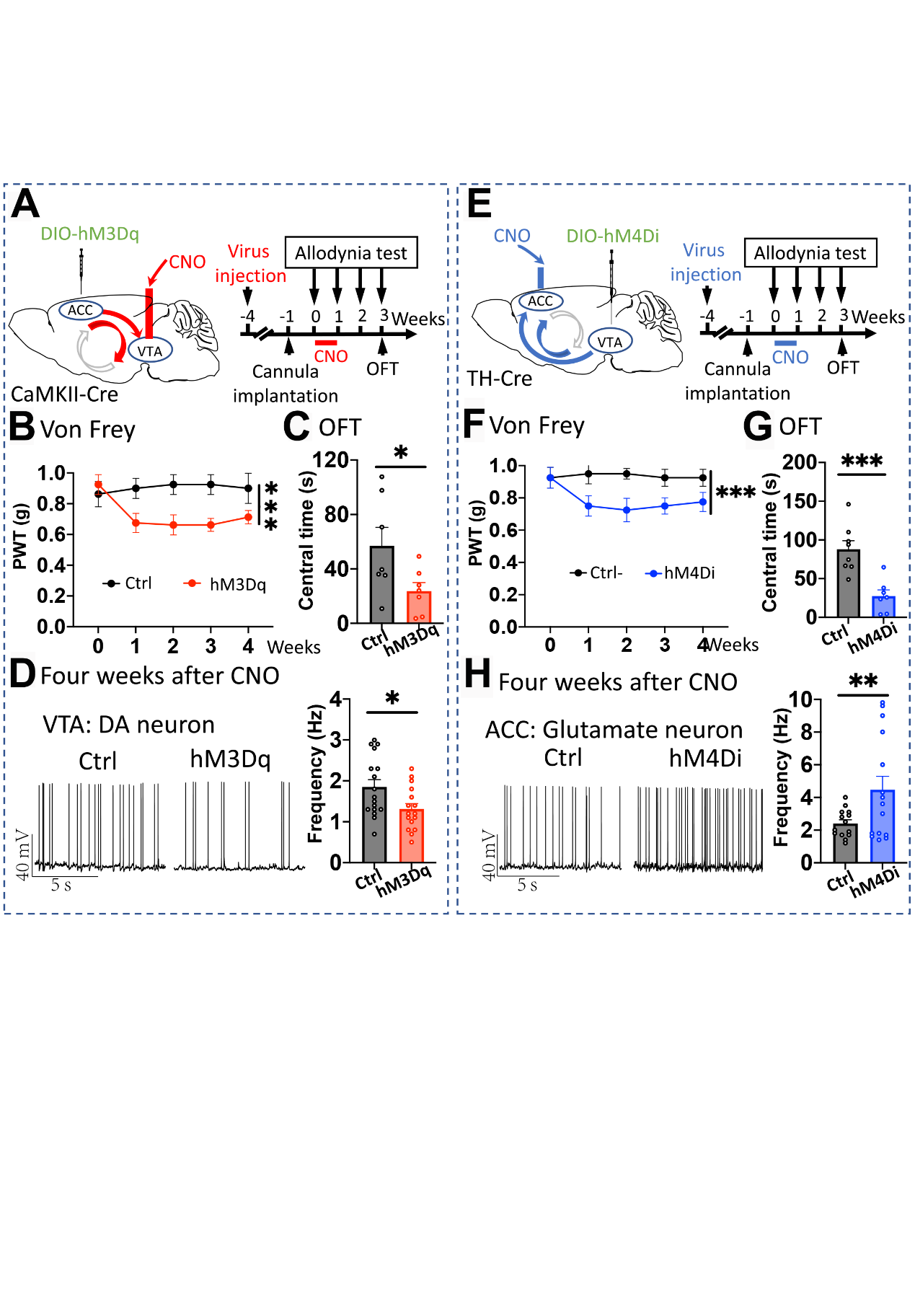
图4激活ACCGlu-VTAGABA-VTADA- ACCGlu正反馈环路导致长期痛觉异常及负性情绪改变
(图源:Qian Song,et al.,Nature Neuroscience, 2024)
ACC-VTA-ACC正反馈闭环是慢性痛治疗的重要靶点
为进一步证明ACC-VTA-ACC正反馈闭环在慢性痛进展中的关键作用,团队成员分别在SNI小鼠造模早期和6周后关闭/降低该正反馈环路,发现它们均可缓解SNI模型小鼠的痛敏异常,且其缓解效应逐步增强,更重要的是,这种缓解作用在停止给药后仍可继续维持(图5)。鉴于多巴胺D2受体(D2R)不仅是DA神经元自抑制的关键机制,还是VTADA神经元抑制ACCGlu神经元的重要分子机制,团队发现无论是在ACC区局部给予D2R激动剂(quinpirole)抑制ACCGlu神经元,还是在VTA区局部给予D2R拮抗剂(haloperidol,精神类疾病的重要临床药物)兴奋VTADA神经元,均可长期缓解SNI小鼠的痛觉异常与相关的负性情绪改变。这些结果表明,ACC-VTA-ACC正反馈闭环还是慢性痛的重要治疗靶点,为其临床治疗提供了全新的思路和用药方案。
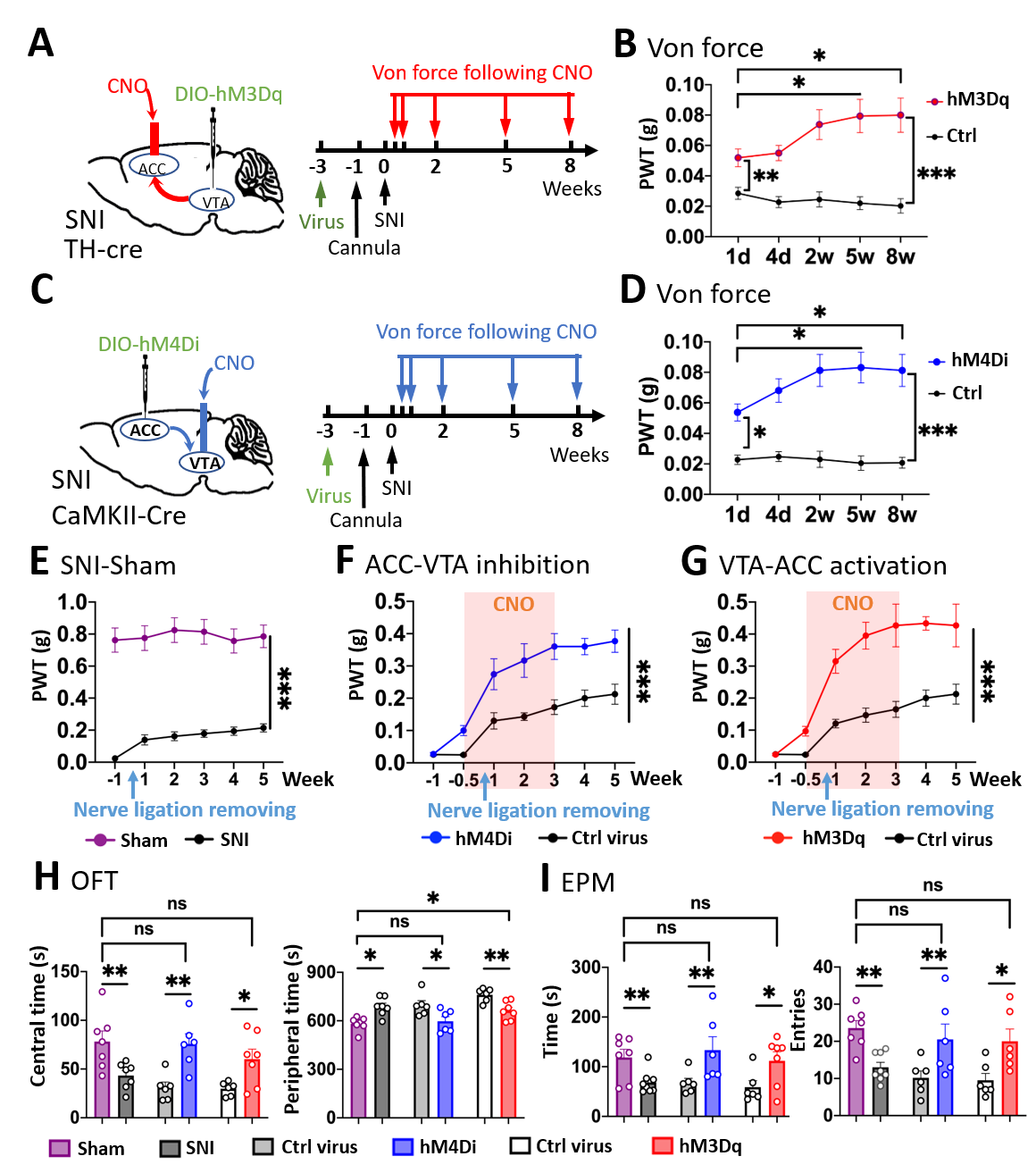
图5靶向ACCGlu-VTAGABA-VTADA- ACCGlu环路长期缓解慢性痛及其负性情绪
(图源:Qian Song,et al.,Nature Neuroscience, 2024)
该研究成果于2024年1月3日在Nature Neuroscience(神经领域排名第一)上发表了题为《ACC-VTA-ACC正反馈神经闭环介导神经痛及其负性情绪的长期维持》“An ACC-VTA-ACC positive-feedback loop mediates the persistence of neuropathic pain and emotional consequences”的研究论文。西安交通大学生命学院王昌河教授为本文的通讯作者,美国马里兰大学魏峰教授、西南医科大学康新江教授和美国霍普金斯大学柴祖映博士为共同通讯作者。西安交通大学生命学院副教授宋茜、博士生韦安琪、副教授徐华栋和博士生顾禹豪为本文的共同第一作者。西安交通大学分析测试中心郝英工程师协助完成Confocal成像数据的采集。本研究得到北京大学周专教授、西南医科大学附属医院江涌教授、西安交通大学第一附属医院屈秋民教授和空军军医大学陈涛教授的通力合作,西安交通大学卓敏教授、空军军医大学罗层教授、清华大学曾文文教授为本研究提供了宝贵意见和帮助。本研究获得国家自然科学基金、国家科技创新项目、陕西省科技创新团队项目、陕西省杰出青年基金、陕西省重点研发计划、中国博士后基金等项目资助。

ACCGlu-VTAGABA-VTADA- ACCGlu正反馈神经环路介导慢性痛及其负性情绪的示意图
原文链接:https://www.nature.com/articles/s41593-023-01519-w
下载全文:https://rdcu.be/du2Z8
